


• 원소의 주기율이 각 원소의 전자 배치와 관련이 있다는 것을 이해할 수 있다.
• 주기율표에서 원소의 성질이 주기적으로 변하는 현상을 설명할 수 있다.
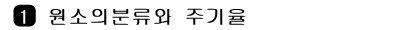
- 멘델레예프(Mendeleev, D. I.) 주기율표
- 1869년 러시아의 멘델레예프는 그 당시 발견된 63종의 원소 를 원자량을 기준으로 나열해 본 뒤, 성질이 비슷한 원소가 주기적으로 나타나는 비율인 주기율을 발견
- 몇몇 원소들의 성질이 주기성에서 벗어나는 문제점
- 모즐리(Moseley, H. G. J.) 주기율표
- 1913년 영국의 모즐리는 X선 연구를 통해 원소들의 원자핵의 양전하를 결정하는 방법을 알아내어, 이를 토대로 원소들의 원자 번호를 결정
- 원소를 원자 번호 순으로 배열하여 멘델레예프 주기율표의 단점을 보완한 새로운 주기율표를 완성
- 원소를 원자 번호 순으로 나열하면서 원소의 화학적 성질이주기적으로 나타나도록 배열
- 18개의 세로줄과 7개의 가로줄, 그리고 7개의 가로줄 중 일부를 따로 떼어 낸 2개의 가로줄로 구성
- 각 가로줄을 주기, 세로줄을 족
- 같은 족에 속하는 원소를 동족원소
- 1주기에는 H와 He만 있으며, 2주기와 3주기에는 각각 8개의 원소
- 4,
5주기에는 3족부터 12족 사이에 들어 있는 각각 10개의 원소를 포함하여 총 18개의 원소
- 6주기는 란타넘족의 14개 원소들을 포함해서 모두 32개의 원소
- 7주기는 악티늄족의 14개 원소를 포함한 26개의 원소
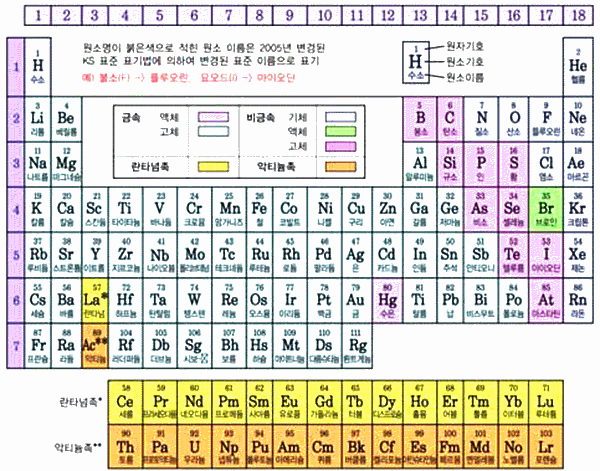
그림 I-9 현대의 주기율표
- 주기율표의 분류

- 주기율표 원소들을 크게 금속 원소와 비금속 원소로 분류
- 금속은 상온에서 액체인 수은(Hg)을 제외하고는 모두 고체
- 전자를 잃고 양이온으로 잘 바뀌며,
금속 결합으로 광택의 고체, 열·전기 전도성이 크며, 연성과 전성
- 비금속은 상온에서 액체인 브로민(Br2)을 제외하고는 모두 기체와 고체
- 전자를 얻어 음이온이 되기 쉬우며,
대부분 기체와 고체로 존재, 열·전기부도체
- 금속과 비금속 사이에는 준금속 원소라는 원소가 있으며, 준금속 원소는 금속과비금속의 중간적인 성질 또는 양쪽 모두의 성질
그림 I-10 주기율표의 금속성과 비금속성
- A족(1-2족, 13-18족)에 있는 원소
- 주기율표에서 왼쪽 아래로 갈수록 금속성이 커지고, 오른쪽 위로 갈수록 비금속성이 커진다.
- 금속성이 커질수록 수용액 중에서 양이온이 되기 쉽고, 비금속성이 커질수록 수용액 중에서 음이온이 되기 쉽다.
- 넓은 범위에 걸친 화학적 성질과 물리적 성질을 가지며 이들의 화합물들은 대부분 무색이다.
알칼리 금속, 알칼리 토금속, 할로겐 원소, 비활성 기체 등
- 전형 원소의 종류
- 알칼리 금속 (1족) : 리튬,
나트륨, 칼륨, 루비듐
- 알칼리 토금속(2족) : 마그네슘, 칼슘, 스트론튬, 바륨
Mg,
Ca, Sr, Ba
- 할로겐 원소(17족) : 플루오르, 염소, 브롬, 요오드
F,
Cl, Br, I
- 비활성 기체(18족) : 헬륨, 네온, 아르곤, 크립톤 등
-
전이 원소
- 3-12족 원소
- 금속, 전이 금속
- 색이 있는 화합물 형성
- 내부전이원소 –란탄계, 악티늄계 원소

1. 원소를 냐열하는 기준에 따라 현대 주기율표와 멘델레예프 주기율표의 차이를 설명해 보자.

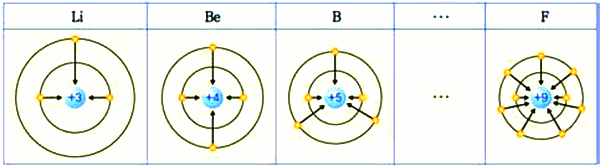
- 다음 그림을 보고, 원자 배치에 따른 원자의 주기성을 탐구해 보자.
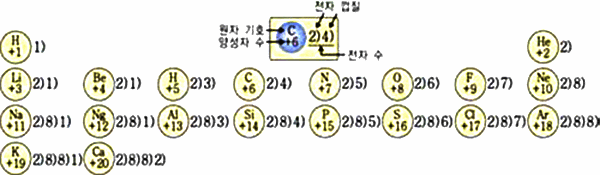
그림 I-11 전자 배치와 주기율

- 원자핵 속에 들어 있는 양성자 수에 따라서 원자 번호를 부여하였다.
- 같은 족에서는 원자가 전자 수가 같고, 같은 주기는 전자 껍질 수가 같다.
- 주기율표에서 원소의 전자 배치는 족과 주기에 따라 일정한 경향이 나타난다.
- 같은 족
- 원자가 전자 수가 같으므로 화학적 성질이 비슷
- 같은 주기
- 전자 껍질의 수가 같다
- 주기가 커질수록 전자 껍질수가 증가하여 최외각 전자는 핵으로부터 멀어짐

2. 다음과 같은 전자 배치를 가지는 원소의 족과 주기는 각각 무엇인가?

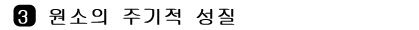

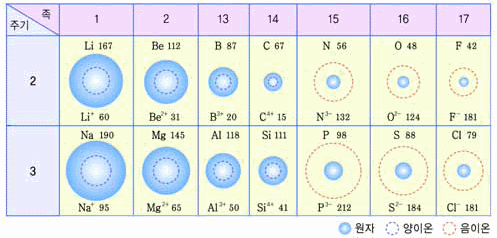
- 원자 반지름을 설명한 아래 그림을 참고하여 원자 반지름의 주기성을 탐구해보자
그림 I-12 원자 반지름

- 같은 족에서는 원자 번호가 증가할수록 원자 반지름이 증가한다.
- 같은 주기에서는 원자 번호가 증가할수록 원자 반지름이 감소한다.
- 원자 반지름
- 같은 종류의 원자가 결합하였을 때, 두 원자간의 핵간 거리의 반

그림 I-13 원자 반지름의 측정
- 원자 반지름의 크기는 전자 컵질의 수와 원자핵 전하(양성자 수)가 큰 영향
- 같은 주기
- 원자 번호가 증가할수록 양성자 수가 증가하여 유효 핵전하가 커진다.
- 유효 핵전하가 커지면 핵과 전자 사이의 인력이 증가하여 전자가 원자핵 쪽으로 강하게 끌리게 되므로 원자의 반지름은 작아진다.
- 같은 족
-
원자 번호가 클수록 원자핵의 전하량이 증가하여 원자핵과 가장
바깥 껍질에 있는 전자 사이의 인력도 커진다.
- 하지만 전자 껍질수의 증가에 의한
반지름 증가 요인이 더 커지기 때문에 원자 번호가 클수록 원자 반지름은 증가
한다.
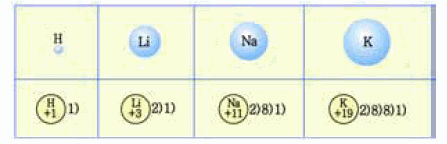
그림 I-15 같은 족에서 원자 반지름 비교

3. 다음 원자들을 원자 반지름이 큰 순서대로 나열하고, 그 이유를 설명하시오.
1) F, Cl, Br
2) N, O, F

-
아래의 이온화 에너지 그림을 참고하여, 원자 번호 증가에 따른 이온화 에너지의 주기적 경향성을 탐구해 보자.
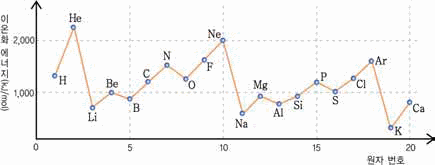
그림 I-20 이온화 에너지의 주기성


4. 다음 중 제1 이온화 에너지가 가장 큰 원소를 고르시오.
1) Li, Na, K 2) O, F, Ne
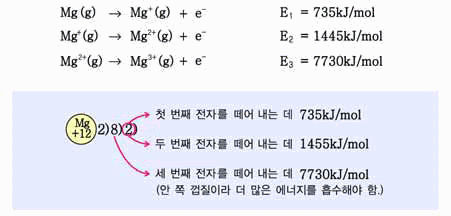
5. 다음은 3주기 원소의 순차적 이온화 에너지를 나타낸 것이다. 이 원소의 원자가 전자수를 예측해 보고, 그 이유를 설명하시오.
E1 = 580kJ/mol
-
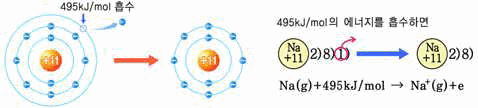
전자 친화도
-
기체 상태로 존재하는 유리된 원자에 전자 하나를 더하는 과정에서 발생하는 에너지 원자+전자→음이온+전자친화도
-
같은 주기에서 원자 번호가 증가하면 커진다.
-
같은 족에서 주기 수가 증가하면 작아진다.
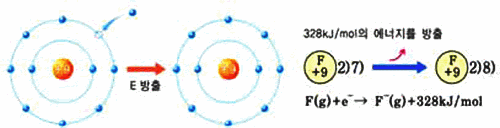
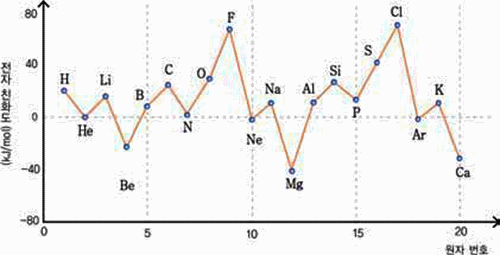

6. 금속성은 F가 Cl보다 크지만, 전자 친화도는 F보다 Cl이 크다. 그 이유는 무엇인가?
7. 같은 주기에서 비활성 기체의 전자 친화도가 작은 편이다. 그 이유는 무엇이라고 생각
하 는가?















![]()
![]()




![]()




![]()
![]()


![]()